Projekt: NCBiR TANGO-IV-A/0003/2019-00
Tytuł: Innowacyjny produkt leczniczy przeciwko Clostridioides difficile oparty o przeciwciała IgY
Termin realizacji: 1.10.2020 – 31.12.2021
Streszczenie: Projekt dotyczy opracowania polskiego, innowacyjnego rozwiązania w leczeniu zakażeń wywołanych szczepami Clostridioides difficile i mieści się w dziedzinie nauki wiodącej dla rozwoju społecznego i gospodarczego Polski, a także wpisuje się w założenia Narodowego Programu Ochrony Antybiotyków i rekomendacje Unii Europejskiej. Głównym rezultatem projektu będzie preparat do leczenia zakażeń oparty na kurzych przeciwciałach IgY skierowanych przeciwko epitopom bakterii Clostridioides diffiicle.Efektem końcowym realizacji projektu będzie doustna formulacja złożona z ochronnych przeciwciał IgY gotowa do użycia w testach klinicznych, które mogą zostać przeprowadzone w przyszłości we współpracy z partnerem biznesowym. W ramach opisywanego projektu zostaną zabezpieczone prawa do powyższego produktu, zostanie określone zapotrzebowanie rynkowe na dany produkt i dalsza strategia jego rozwoju.
Wartość projektu: 249 119,13 PLN
Clostridioides difficile (CD) należy do grupy oportunistycznych, anaerobowych bakterii wywołujących schorzenia układu pokarmowego ludzi i zwierząt. Są to Gram-dodatnie laseczki wytwarzające groźne dla zdrowia toksyny (A i B) oraz spory o dużej odporności na wysokie temperatury oraz powszechnie stosowane środki utrzymania czystości [1]. CD nie jest bakterią inwazyjną, ale po długotrwałej antybiotykoterapii i zahamowaniu rozwoju prawidłowej flory bakteryjnej pacjenta powoduje biegunkę poantybiotykową, która dotyka nawet 10% hospitalizowanych osób. Do najczęstszych powikłań po zakażeniu CD należy rzekomobłoniaste zapalenie jelita grubego (u 25% chorych), a bardzo ciężka postać zakażenia występuje u 3% chorych i u 11% chorych, którzy zarazili się szczepem hiperwirulentnym [2]. Może dojść do mnogich perforacji jelita, zapalenia otrzewnej z wtórną posocznicą i zgonem. W ciągu ostatnich dziesięciu lat w krajach wysoko rozwiniętych nastąpił wyraźny wzrost zapadalności oraz ciężkości przebiegu zakażeń. Co więcej, nawrót choroby po pierwszym leczeniu występuje u około 20% chorych, po drugim leczeniu u około 40% [3]. Dane zebrane przez ECDC (European Centre for Disease Prevention and Control) z 556 szpitali z 20 krajów europejskich wykazały 7 711 przypadków zakażeń CD w 2016 roku. Autorzy raportu zwracają jednak uwagę na znaczne niedoszacowanie tej liczby ze względu na niską liczbę przeprowadzanych testów oraz na brak odgórnego wymogu zgłaszania takich przypadków [4]. Co więcej, testy są przeprowadzane głównie w szpitalach wysokospecjalistycznych, a do zakażeń dochodzi najczęściej na oddziałach wewnętrznych, geriatrycznych oraz domach opieki. Starsze dane mówią o ponad 120 000 przypadków zakażeń CD w 2011 roku w Europie, z których od 3 do 30% zakończyło się śmiercią pacjenta. Szacuje się, że koszt leczenia pojedynczego pacjenta wynosi około 9 000 euro i jest ściśle uzależniony od czasu jaki pacjent musi dodatkowo spędzić w szpitalu [5].
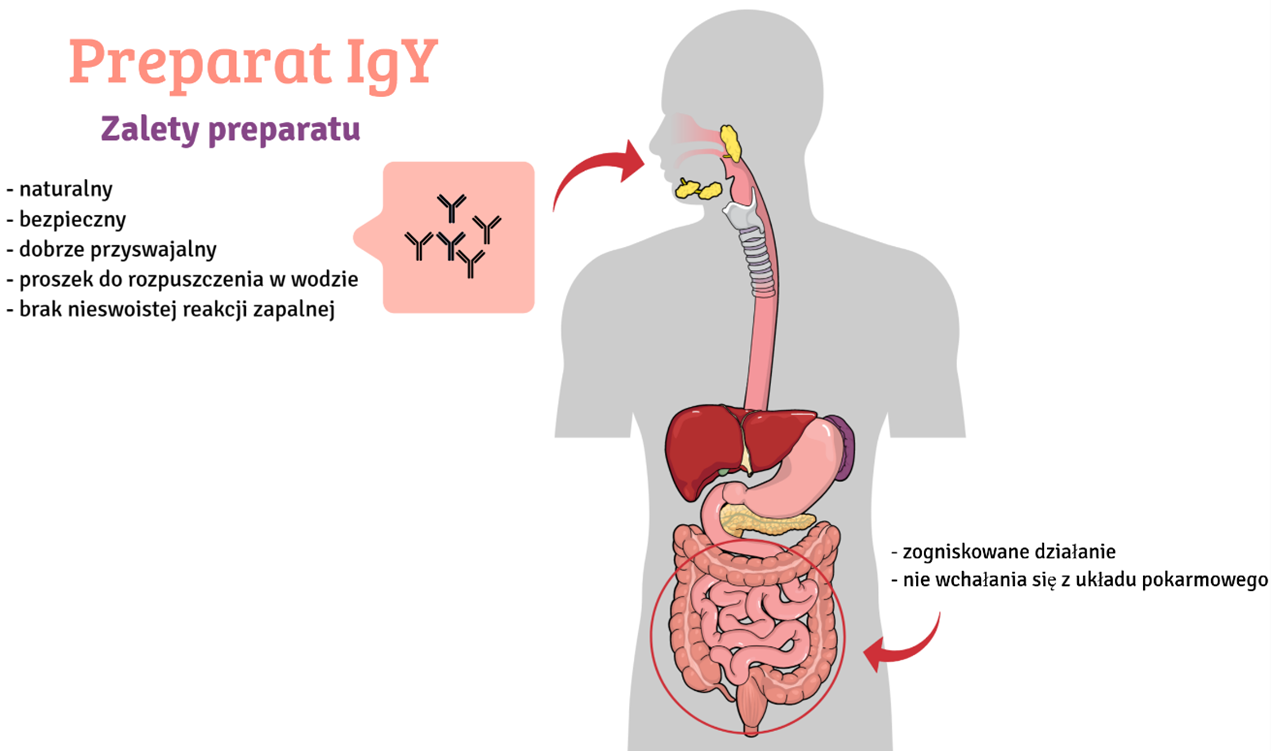
Na rynku polskim brak jest leków przeciwko Clostridioides difficile innych niż antybiotyki. Warto wspomnieć, że bakterie CD są oporne na wiele powszechnie stosowanych antybiotyków (cefalosporyny, fluorochinolony, karbapenemy, klindamycyna, monobaktamy, mniej na makrolity, penicyliny, sulfonamidy i trimetoprim), a także względem antybiotyków stosowanych do ich zwalczania [6,7]. Nie ma również terapii ani suplementów, które by działały wspomagająco i przyspieszały powrót do zdrowia. Profilaktyka zakażeń sprowadza się do częstego mycia rąk oraz użycia rękawiczek jednorazowych, co nie do końca wydaje się być skuteczne. Proponowany przez nas produkt działa na zupełnie innej zasadzie niż antybiotyki. Oparty jest o bezpieczne, nietoksyczne przeciwciała IgY izolowane z jaj kur immunizowanych koniugatem epitopu specyficznego względem białek zlokalizowanych na powierzchni komórki CD. Szczepienie kur (powszechnie dostępne, niski koszt utrzymania) konkretnym epitopem powoduje produkcję specyficznych, ochronnych przeciwciał w znacznie większym stężeniu w stosunku do produktów, które otrzymuje się na drodze szczepienia całą bakterią.
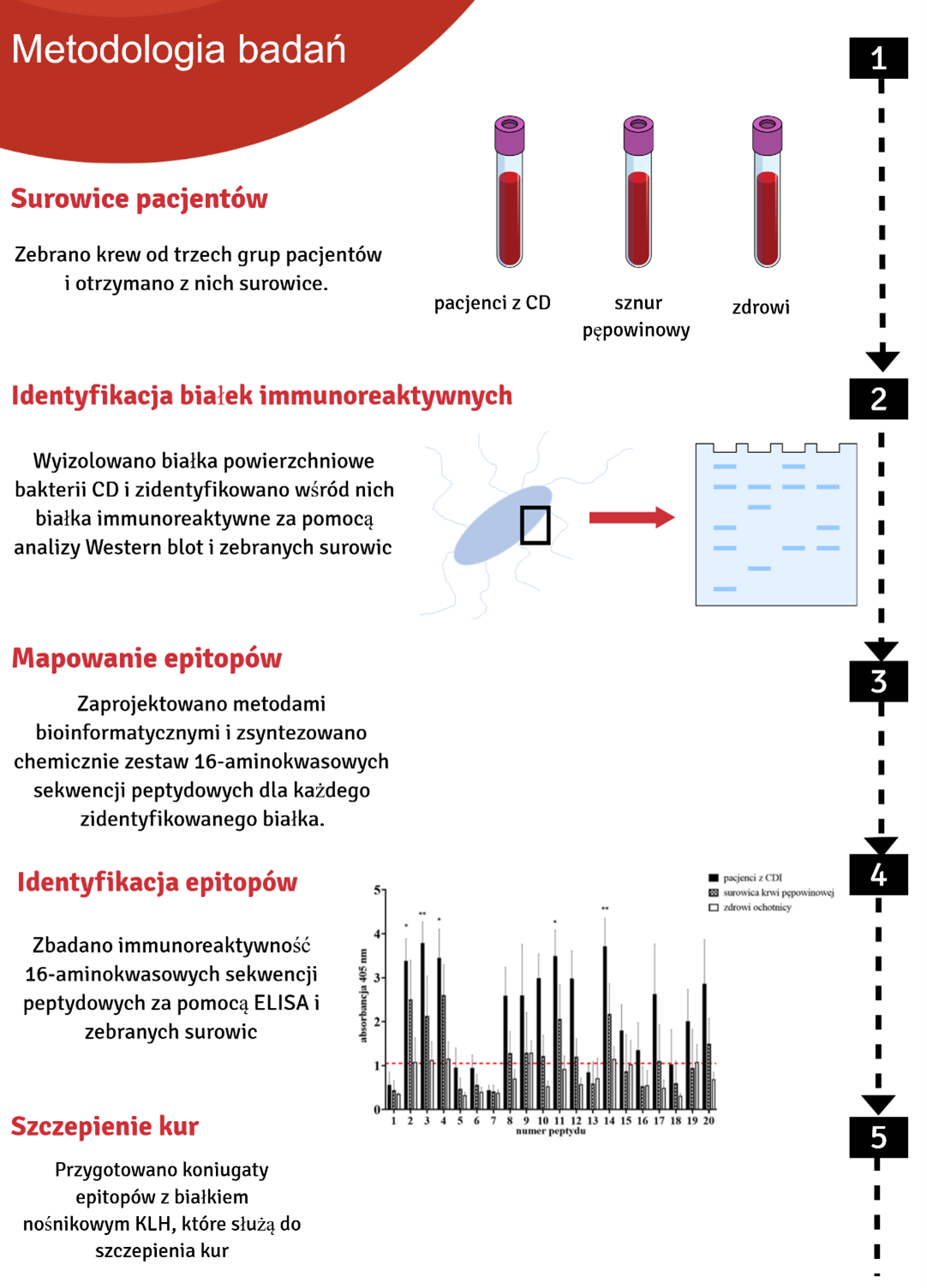
Nasze badania oparliśmy o białka immunoreaktywne zlokalizowane na powierzchni komórki, które zidentyfikowaliśmy za pomocą surowicy trzech grup: pobrana od osób zakażonych CD, sznura pępowinowego i od zdrowych ochotników. Zastosowanie surowicy izolowanej ze sznura pępowinowego to podejście nowatorskie, które pozwoliło nam na określenie epitopów o właściwościach potencjalnie silnie ochronnych. W wyniku naszych działań określiliśmy 4 epitopy z czterech różnych białek CD zlokalizowanych na powierzchni bakterii. Część z naszych badań została opublikowana w uznanych czasopismach [8,9]. Uzyskane epitopy posłużyły do przygotowania szczepionki, którą następnie będą immunizowane kury. Z jaj szczepionych kur izolowane są duże ilości specyficznych przeciwciał IgY (ok. 10 mg/jajo), znacznie większe niż w przypadku skrwawiania innych zwierząt np. królika [10]. Dzięki skupieniu się na celach znajdujących się na powierzchni komórki preparat zadziała już na etapie wejścia bakterii do organizmu, zanim jeszcze dojdzie do namnożenia bakterii i produkcji niszczących jelito toksyn.
Potencjalnymi odbiorcami preparatu mogą być dwie duże grupy osób. Pierwsza, pacjenci przed planowanym zabiegiem w szpitalu, szczególnie osoby powyżej 60 roku życia czy o obniżonej odporności. Druga, osoby już zakażone stosujące preparat wspomagająco w terapii antybiotykowej, co potencjalnie skróci czas trwania kuracji. Nie należy jednak zawężać grup odbiorców ponieważ preparat mógłby być również stosowany zapobiegawczo u osób znajdujących się w jednostkach opieki długoterminowej, paliatywnej oraz u osób często stosujących antybiotyki w warunkach domowych.
Proponowany przez nas preparat cechuje się tym, że jest pochodzenia naturalnego przez co jest bezpieczny. Jego otrzymanie nie jest kosztowne, a metody produkcji powszechnie stosowane. Preparat cechuje się dużo wyższą specyficznością niż preparaty otrzymywane poprzez immunizację kur całą bakterią. Preparat będzie łatwy w stosowaniu w postaci proszku do rozpuszczenia w wodzie (możliwe inne formy produktu np. granulat, tabletka). Przeciwciała IgY są odporne na warunki panujące w układzie pokarmowym przez co nie ma potrzeby stosowania wyszukanych formulacji. Są również odporne na podwyższoną temperaturę więc preparat nie wymaga przechowywania w lodówce.
Zespół zaangażowany w projekt:
Prof. dr hab. Andrzej Gamian – kierownik
Dr hab. inż. Sabina Górska
Dr Agnieszka Razim
Mgr Katarzyna Pacyga-Prus
Mgr inż. Swen Stręk
- Gerding, D.N.; Johnson, S.; Peterson, L.R.; Mulligan, M.E.; Silva, J., Jr Clostridium difficile-associated diarrhea and colitis. Infect Control Hosp Epidemiol 1995, 16, 459–477.
- Pépin, J.; Routhier, S.; Gagnon, S.; Brazeau, I. Management and outcomes of a first recurrence of Clostridium difficile-associated disease in Quebec, Canada. Clin. Infect. Dis. 2006, 42, 758–764, doi:10.1086/501126.
- McFarland, L.V.; Elmer, G.W.; Surawicz, C.M. Breaking the cycle: treatment strategies for 163 cases of recurrent Clostridium difficile disease. Am. J. Gastroenterol. 2002, 97, 1769–1775, doi:10.1111/j.1572-0241.2002.05839.x.
- Healthcare-associated infections: Clostridium difficile infections – Annual Epidemiological Report for 2016 Available online: http://ecdc.europa.eu/en/publications-data/healthcare-associated-infections-clostridium-difficile-infections-annual (accessed on Dec 29, 2018).
- Heister, T.; Wolkewitz, M.; Hehn, P.; Wolff, J.; Dettenkofer, M.; Grundmann, H.; Kaier, K. Costs of hospital-acquired Clostridium difficile infections: an analysis on the effect of time-dependent exposures using routine and surveillance data. Cost Effectiveness and Resource Allocation 2019, 17, 16, doi:10.1186/s12962-019-0184-5.
- Bielec, D.; Stempkowska, J.; Markiewicz-Zięba, M. Postępy w leczeniu zakażenia Clostridium difficile. Postępy Nauk Medycznych 2014, XXVII.
- Freeman, J.; Vernon, J.; Morris, K.; Nicholson, S.; Todhunter, S.; Longshaw, C.; Wilcox, M.H.; Pan-European Longitudinal Surveillance of Antibiotic Resistance among Prevalent Clostridium difficile Ribotypes’ Study Group Pan-European longitudinal surveillance of antibiotic resistance among prevalent Clostridium difficile ribotypes. Clin. Microbiol. Infect. 2015, 21, 248.e9-248.e16, doi:10.1016/j.cmi.2014.09.017.
- Razim, A.; Pacyga, K.; Martirosian, G.; Szuba, A.; Gamian, A.; Myc, A.; Górska, S. Mapping Epitopes of a Novel Peptidoglycan Cross-Linking Enzyme Cwp22 Recognized by Human Sera Obtained from Patients with Clostridioides difficile Infection and Cord Blood. Microorganisms 2019, 7, 565, doi:10.3390/microorganisms7110565.
- Pacyga, K.; Razim, A.; Martirosian, G.; Aptekorz, M.; Szuba, A.; Gamian, A.; Myc, A.; Górska, S. The Bioinformatic and In Vitro Studies of Clostridioides Difficile Aminopeptidase M24 Revealed the Immunoreactive KKGIK Peptide. Cells 2020, 9, 1146, doi:10.3390/cells9051146.
- Ferreira Júnior, Á.; Santiago, F.M.; Silva, M.V.; Ferreira, F.B.; Macêdo Júnior, A.G.; Mota, C.M.; Faria, M.S.; Silva Filho, H.H.; Silva, D.A.O.; Cunha-Júnior, J.P.; et al. Production, characterization and applications for Toxoplasma gondii-specific polyclonal chicken egg yolk immunoglobulins. PLoS ONE 2012, 7, e40391, doi:10.1371/journal.pone.0040391.
Broszura informacyjna Information brochure